QUÍMICA
Se denomina química (del árabe kēme (kem, كيمياء), que significa "tierra") a la ciencia que estudia la composición, estructura y propiedades de la materia, como los cambios que ésta experimenta durante las reacciones químicas y su relación con la energía. Históricamente la química moderna es la evolución de la alquimia tras laRevolución química (1733).
Las disciplinas de la química han sido agrupadas por la clase de materia bajo estudio o el tipo de estudio realizado. Entre éstas se tienen la química inorgánica, que estudia la materia inorgánica; la química orgánica, que trata con la materia orgánica; la bioquímica, el estudio de substancias en organismos biológicos; la físico-química, comprende los aspectos energéticos de sistemas químicos a escalas macroscópicas, moleculares y atómicas; la química analítica, que analiza muestras de materia tratando de entender su composición y estructura. Otras ramas de la química han emergido en tiempos recientes, por ejemplo, la neuroquímica que estudia los aspectos químicos del cerebro.
MATERIA
Materia es todo aquello que ocupa un lugar en el espacio, tiene una energía medible y está sujeto a cambios en el tiempo y a interacciones con aparatos de medida. En física y filosofía, materia es el término para referirse a los constituyentes de la realidad material objetiva, entendiendo por objetiva que pueda ser percibida de la misma forma por diversos sujetos. Se considera que es lo que forma la parte sensible de los objetos perceptibles o detectables por medios físicos. Es decir es todo aquello que ocupa un sitio en el espacio, se puede tocar, se puede sentir, se puede medir, etc.
También se usa el término para designar al tema que compone una obra literaria, científica, política, etc. Esta distinción da lugar a la oposición "materia-forma", considerando que una misma materia, como contenido o tema, puede ser tratado, expuesto, considerado, etc. de diversas formas: de estilo, de expresión, de enfoque o punto de vista. Se usa también para hablar de una asignatura o disciplina en la enseñanza.
MASA
La masa, en física, es la cantidad de materia de un cuerpo.1 Es una propiedad intrínseca de los cuerpos que determina la medida de la masa inercial y de la masa gravitacional. La unidad utilizada para medir la masa en el Sistema Internacional de Unidades es el kilogramo (kg). Es una cantidad escalar y no debe confundirse con el peso, que es una cantidad vectorial que representa una fuerza.

PESO
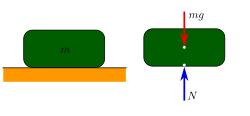
En física, el peso es la fuerza con la cual un cuerpo actúa sobre un punto de apoyo, originado por la aceleración de la gravedad, cuando esta actúa sobre la masadel cuerpo. Al ser una fuerza, el peso es en sí mismo una cantidad vectorial, de modo que está caracterizado por su magnitud y dirección, aplicado en el centro de gravedad del cuerpo y dirigido aproximadamente hacia el centro de la Tierra. Por extensión de esta definición, también podemos referirnos al peso de un cuerpo en cualquier otro astro (Luna, Marte, ...) en cuyas proximidades se encuentre.
Sin duda alguna, el peso es la fuerza con la que estamos más familiarizados, por nuestra experiencia diaria, al ejercerla la Tierra sobre todos los cuerpos materiales,acelerándolos, en caída libre (en ausencia del concurso de otras fuerzas). Podemos determinar el peso de un cuerpo cualquiera, de masa m, midiendo la aceleración que adquiere cuando se le deja caer libremente de modo que la única fuerza que actúe sobre él sea la de la gravedad. Desde los experimentos deGalileo, es bien conocido que la aceleración que adquiere cualquier cuerpo en caída libre, que designaremos por g, es independiente de la masa del cuerpo. El valor de esa aceleración es aproximadamente 9.81 m/s² en el nivel del mar y para las latitudes medias; entonces el peso P de un cuerpo de masa m viene dado por P =mg.
VOLUMEN
El volumen es una magnitud escalar definida como el espacio ocupado por un cuerpo. Es una función derivada ya que se halla multiplicando las tres dimensiones.
En matemáticas el volumen es una medida que se define como los demás conceptos métricos a partir de una distancia o tensor métrico.
En física, el volumen es una magnitud física extensiva asociada a la propiedad de los cuerpos físicos de ser extensos, que a su vez se debe al principio de exclusión.
La unidad de medida de volumen en el Sistema Internacional de Unidades es el metro cúbico, aunque temporalmente también acepta el litro, que se utiliza comúnmente en la vida práctica.
PROPIEDADES GENERALES DE LA MATERIA
Materia es todo lo que tiene masa, ocupa espacio y se puede percibir por nuestros sentidos. Gran parte de las cosas necesarias para nuestra vida diaria están compuestas de materia y es la química la que se interesa en la composición y las transformaciones que sufre la materia. El químico estudia las propiedades de la materia para poder identificar, clasificar y dar usos a sus componentes. En este módulo estudiaremos algunos conceptos básicos relacionados con la materia. |
La materia puede existir en tres estados físicos y pasar de un estado físico a otro sin que cambie su composición (cambio físico). Además la materia puede sufrir unos cambios químicos. Los cambios químicos son transformaciones que convierten una sustancia en otra (reacciones químicas). Algunos ejemplos de cambios químicos son el enmohecimiento del hierro y la combustión de una sustancia. |
Estado | Características | Cambio físico |
| Sólido | Tienen forma y volumen definido | Fusión-cambiar del estado sólido al líquido Sublimación- cambiar del estado sólido al gaseoso |
| Líquido | Tienen volumen definido pero su forma es variable | Congelación- cambiar del estado líquido a sólido Evaporación- cambiar del estado líquido a gaseoso |
| Gas | No tienen forma ni volumen definido: toman la forma y el volumen del envase que los contiene | Condensación- cambiar del estado gaseoso a líquido Deposición- cambiar del estado gaseoso al sólido |
| Toda sustancia presenta un conjunto de características que nos permite reconocerla y distinguirla de las demás sustancias. Estas características reciben el nombre de propiedades y pueden clasificarse en propiedades físicas y propiedades químicas. Además pueden clasificarse en propiedades intensivas o extensivas. |
Propiedad | Característica | Ejemplos |
| física | no alteran la identidad de la materia | color, estado físico, masa, peso, volumen, punto de ebullición |
| química | describe la capacidad de una sustancia para transformarse en otra | la combinación del hierro con oxígeno y agua para formar moho, el papel se quema, el hidrógeno reacciona con oxígeno al pasar una corriente eléctrica y produce agua |
| intensiva | no depende de la cantidad de sustancia presente | color, punto de ebullición, punto de fusión, densidad |
| extensiva | depende de la cantidad de sustancia presente | peso, volumen, largo, ancho, masa, altura |
| Grupo 3 al 12 – Elementos de transición | Elementos de transición internos: |
| Grupo IA ó 1 metales alcalinos | Lantánidos (Ce hasta Lu) |
| Grupo IIA ó 2 metales alcalinotérreos | |
| Grupo VIIA ó 17 halógenos | Actínidos (Th hasta Lr) |
| Grupo VIIIA ó 18 gases nobles |
Ley | Establece |
Conservación de Masa | Durante los cambios químicos no ocurren cambios apreciables en masa |
Composición Constante | Un compuesto, no importa su origen, siempre contiene los mismos elementos y en la misma razón por peso |
Proporciones Múltiples | Cuando dos elementos se combinan para formar mas de un compuesto, las masas de un elemento que se combinan con una masa fija del otro elemento están en razón o relaciones de números enteros |
Tabla 3 Leyes de la materia
La Teoría Atómica del Dalton está bien, sin embargo, deja afuera una pregunta importante que es: ¿De qué esta hecho el átomo? No fue hasta finales del siglo que la evidencia experimental demostró que los átomos están constituidos por unidades todavía más pequeñas que llamamos partículas subatómicas. Tres de estas partículas son importantes para nuestro curso. Estos son el electrón, el protón y el neutrón, Tabla 4. |
Tabla 4: Comparación de partículas subatómicas
El arreglo de partículas fundamentales en el átomo fue revelado por el experimento de Rutherford de dispersión de partículas alfa en una placa metálica fina. El experimento reveló que el átomo contiene un núcleo cargado positivamente, toda la masa del átomo está en el núcleo y el tamaño del núcleo es bien pequeño comparado con el tamaño del átomo. Con estos resultados podemos llegar a la conclusión de que los protones y neutrones, que son los que tienen mayor masa están en el núcleo y que los electrones se encuentran en el espacio alrededor del núcleo. | |||||||||
Los átomos de un elemento pueden diferir en el número de neutrones y por lo tanto en su número de masa. Estos reciben el nombre de isótopos. Los isótopos de un elemento presentan las mismas propiedades químicas, pero difieren en propiedades físicas. Ejemplos de estos son: Hidrógeno , Deuterio y Tritio . Generalmente para hacer referencia a un isótopo damos el símbolo del elemento y el número de masa que corresponde al isótopo. Por ejemplo H-1, H-2 y H-3. Debido a la existencia de isótopos naturales, la masa de un elemento se expresa como masa atómica promedio y se puede determinar si se conoce la masa relativa de los isótopos y la abundancia relativa de cada uno. Esta información la provee un espectrómetro de masa. | |||||||||
Ejemplo:
Masa atómica promedio = [(10.0129)(0.1991)]+ [(11.0093)(0.8009)] = 10.81 uma | |||||||||
La masa atómica relativa de un átomo se obtiene comprandola con la masa del isótopo más abundante de carbono, C-12, al cual se le asignan exactamente 12 unidades de masa atómica (12 uma). | |||||||||
En muy pocas sustancias, el átomo como tal es la unidad estructural de la cual se compone la sustancia. Casi todos los elementos y compuestos están constituidos por unidades estructurales derivadas del átomo. Dos de estas unidades son las moléculas y los iones. Las moléculas son agregados de átomos que permanecen unidos debido a una potente fuerza de atracción que recibe el nombre de enlace químico. Existen varios tipos de enlaces químico. Por ahora nos interesa que conozcan los siguientes: el enlace covalente, el enlace iónico y el enlace metálico. El enlace covalente resulta de la fuerza de atracción entre dos átomos que resulta del compartimiento de electrones. Este tipo de enlace ocurre principalmente entre elementos no-metálicos. El enlace iónico resulta de la transferencia de electrones entre elementos no-metálicos y elementos metálicos y el enlace metálico resulta de elementos metálicos solamente. |
| Estados de la materia |
La materia se presenta en tres estados o formas de agregación: sólido, líquido y gaseoso. Dadas las condiciones existentes en la superficie terrestre, sólo algunas sustancias pueden hallarse de modo natural en los tres estados, tal es el caso del agua. La mayoría de sustancias se presentan en un estado concreto. Así, los metales o las sustancias que constituyen los minerales se encuentran en estado sólido y el oxígeno o el CO2 en estado gaseoso:
 |
| Estado sólido |
Los sólidos se caracterizan por tener forma y volumen constantes. Esto se debe a que las partículas que los forman están unidas por unas fuerzas de atracción grandes de modo que ocupan posiciones casi fijas. En el estado sólido las partículas solamente pueden moverse vibrando u oscilando alrededor de posiciones fijas, pero no pueden moverse trasladándose libremente a lo largo del sólido. Las partículas en el estado sólido propiamente dicho, se disponen de forma ordenada, con una regularidad espacial geométrica, que da lugar a diversas estructuras cristalinas. Al aumentar la temperatura aumenta la vibración de las partículas: |
Estado líquido |
Los líquidos, al igual que los sólidos, tienen volumen constante. En los líquidos las partículas están unidas por unas fuerzas de atracción menores que en los sólidos, por esta razón las partículas de un líquido pueden trasladarse con libertad. El número de partículas por unidad de volumen es muy alto, por ello son muy frecuentes las colisiones y fricciones entre ellas. Así se explica que los líquidos no tengan forma fija y adopten la forma del recipiente que los contiene. También se explican propiedades como la fluidez o la viscosidad. En los líquidos el movimiento es desordenado, pero existen asociaciones de varias partículas que, como si fueran una, se mueven al unísono. Al aumentar la temperatura aumenta la movilidad de las partículas (su energía). |
| Estado gaseoso |
Los gases, igual que los líquidos, no tienen forma fija pero, a diferencia de éstos, su volumen tampoco es fijo. También son fluidos, como los líquidos. En los gases, las fuerzas que mantienen unidas las partículas son muy pequeñas. En un gas el número de partículas por unidad de volumen es también muy pequeño. Las partículas se mueven de forma desordenada, con choques entre ellas y con las paredes del recipiente que los contiene. Esto explica las propiedades de expansibilidad y compresibilidad que presentan los gases: sus partículas se mueven libremente, de modo que ocupan todo el espacio disponible. La compresibilidad tiene un límite, si se reduce mucho el volumen en que se encuentra confinado un gas éste pasará a estado líquido. Al aumentar la temperatura las partículas se mueven más deprisa y chocan con más energía contra las paredes del recipiente, por lo que aumenta la presión: |
CAMBIOS DE ESTADO

En física y química se denomina cambio de estado a la evolución de la materia entre varios estados de agregación sin que ocurra un cambio en su composición. Los tres estados más estudiados y comunes en la tierra son el sólido, el líquido y el gaseoso; no obstante, el estado de agregación más común en nuestro universo es el plasma, material del que están compuestas las estrellas (si descartamos la materia oscura).
Cambios de estado de agregación de la materia == A continuación se describen los diferentes cambios de estado o transformaciones de fase de la materia.
- Fusión: Es el paso de un sólido al estado líquido por medio de la energía térmica; durante este proceso isotérmico (proceso que absorbe energía para llevarse a cabo este cambio) hay un punto en que latemperatura permanece constante. El "punto de fusión" es la temperatura a la cual el sólido se funde, por lo que su valor es particular para cada sustancia. Cuando dichas moléculas se moverán en una forma independiente, transformándose en un liquido.
- Solidificación: Es la transformación de un líquido a sólido por medio del enfriamiento; el proceso es exotérmico. El "punto de solidificación" o de congelación es la temperatura a la cual el líquido se solidifica y permanece constante durante el cambio, y coincide con el punto de fusión si se realiza de forma lenta (reversible); su valor es también específico.
- Vaporización: es el proceso físico en el que un líquido pasa a estado gaseoso. Se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión. Si se continúa calentando el líquido, éste absorbe el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión del agua en estado líquido en agua en estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso. En ese momento es posible aumentar la temperatura del gas.
La evaporación es importante e indispensable en la vida cuando se trata del agua, que se transforma en nube y vuelve en forma de lluvia, nieve, niebla o rocío.
Cuando existe un espacio libre encima de un líquido caliente, una parte de sus moléculas está en forma gaseosa, al equilibrase, la cantidad de materia gaseosa define la presión de vapor saturante, la cual no depende de la temperatura.
- Condensación: Se denomina condensación al cambio de estado de la materia que se encuentra en forma gaseosa a forma líquida. Es el proceso inverso a la vaporización. Si se produce un paso de estado gaseoso a estado sólido de manera directa, el proceso es llamado sublimación inversa. Si se produce un paso del estado líquido a sólido se denomina solidificación.
- Sublimación: es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Al proceso inverso se le denomina Cristalización inversa; es decir, el paso directo del estado gaseoso al estado sólido. Un ejemplo clásico de sustancia capaz de sublimarse es el hielo seco.
Es importante hacer notar que en todas las transformaciones de fase de las sustancias es de que éstas no se transforman en otras sustancias ni sus propiedades, solo cambia su estado físico.
Las diferentes transformaciones de fase de la materia en este caso las del agua son necesarias y provechosas para la vida y el sustento del hombre cuando se desarrollan normalmente.
TABLA PERIÓDICA Y SUS ELEMENTOS
La tabla periódica de los elementos clasifica, organiza y distribuye los distintos elementos químicos, conforme a sus propiedades y características.
Suele atribuirse la tabla a Dmitri Mendeléyev, quien ordenó los elementos basándose en la variación manual de las propiedades químicas, si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. La forma actual es una versión modificada de la de Mendeléyev; fue diseñada por Alfred Werner.
Historia
La historia de la tabla periódica está íntimamente relacionada con varios aspectos del desarrollo de la química y la física:
- El descubrimiento de los elementos de la tabla periódica.
- El estudio de las propiedades comunes y la clasificación de los elementos.
- La noción de masa atómica (inicialmente denominada "peso atómico") y, posteriormente, ya en el siglo XX, de número atómico.
- Las relaciones entre la masa atómica (y, más adelante, el número atómico) y las propiedades periódicas de los elementos.
[editar]
El descubrimiento de los elementosAunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y el mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII cuando el alquimista Henning Brand descubrió el fósforo (P). En el siglo XVIII se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos. A principios del siglo XIX, la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino–térreos, sobre todo gracias a los trabajos de Humphry Davy. En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo XIX, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesĭus, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc.
[editar]
La noción de elemento y las propiedades periódicasLógicamente, un requisito previo necesario a la construcción de la tabla periódica era el descubrimiento de un número suficiente de elementos individuales, que hiciera posible encontrar alguna pauta en comportamiento químico y sus propiedades. Durante los siguientes dos siglos se fue adquiriendo un gran conocimiento sobre estas propiedades, así como descubriendo muchos nuevos elementos.
La palabra "elemento" procede de la ciencia griega, pero su noción moderna apareció a lo largo del siglo XVII, aunque no existe un consenso claro respecto al proceso que condujo a su consolidación y uso generalizado. Algunos autores citan como precedente la frase de Robert Boyle en su famosa obra The Sceptical Chymist, donde denomina elementos "ciertos cuerpos primitivos y simples que no están formados por otros cuerpos, ni unos de otros, y que son los ingredientes de que se componen inmediatamente y en que se resuelven en último término todos los cuerpos perfectamente mixtos". En realidad, esa frase aparece en el contexto de la crítica de Robert Boyle a los cuatro elementos aristotélicos.
A lo largo del siglo XVIII, las tablas de afinidad recogieron un nuevo modo de entender la composición química, que aparece claramente expuesto por Lavoisier en su obra Tratado elemental de Química. Todo ello condujo a diferenciar en primer lugar qué sustancias de las conocidas hasta ese momento eran elementos químicos, cuáles eran sus propiedades y cómo aislarlos.
El descubrimiento de un gran número de nuevos elementos, así como el estudio de sus propiedades, pusieron de manifiesto algunas semejanzas entre ellos, lo que aumentó el interés de los químicos por buscar algún tipo de clasificación.
[editar]
Los pesos atómicosA principios del siglo XIX, John Dalton (1766–1844) desarrolló una nueva concepción del atomismo, al que llegó gracias a sus estudios meteorológicos y de los gases de la atmósfera. Su principal aportación consistió en la formulación de un "atomismo químico" que permitía integrar la nueva definición de elemento realizada por Antoine Lavoisier (1743–1794) y las leyes ponderales de la química (proporciones definidas, proporciones múltiples, proporciones recíprocas).
Dalton empleó los conocimientos sobre proporciones en las que reaccionaban las sustancias de su época y realizó algunas suposiciones sobre el modo como se combinaban los átomos de las mismas. Estableció como unidad de referencia la masa de un átomo de hidrógeno (aunque se sugirieron otros en esos años) y refirió el resto de los valores a esta unidad, por lo que pudo construir un sistema de masas atómicas relativas. Por ejemplo, en el caso del oxígeno, Dalton partió de la suposición de que el agua era un compuesto binario, formado por un átomo de hidrógeno y otro de oxígeno. No tenía ningún modo de comprobar este punto, por lo que tuvo que aceptar esta posibilidad como una hipótesis a priori.
Dalton conocía que 1 parte de hidrógeno se combinaba con 7 partes (8 afirmaríamos en la actualidad) de oxígeno para producir agua. Por lo tanto, si la combinación se producía átomo a átomo, es decir, un átomo de hidrógeno se combinaba con un átomo de oxígeno, la relación entre las masas de estos átomos debía ser 1:7 (o 1:8 se calcularía en la actualidad). El resultado fue la primera tabla de masas atómicas relativas (o pesos atómicos, como los llamaba Dalton) que fue posteriormente modificada y desarrollada en los años posteriores. Las incertidumbres antes mencionadas dieron lugar a toda una serie de polémicas y disparidades respecto a las fórmulas y los pesos atómicos, que sólo comenzarían a superarse, aunque no totalmente, con el congreso de Karlsruhe en 1860.
[editar]
Metales, no metales, metaloides y metales de transiciónLa primera clasificación de elementos conocida, fue propuesta por Antoine Lavoisier, quien propuso que los elementos se clasificaran en metales, no metales y metaloides o metales de transición. Aunque muy práctico y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias en las propiedades físicas como químicas.
[editar]
Tríadas de DöbereinerUno de los primeros intentos para agrupar los elementos de propiedades análogas y relacionarlo con los pesos atómicos se debe al químico alemán Johann Wolfgang Döbereiner (1780–1849) quien en 1817 puso de manifiesto el notable parecido que existía entre las propiedades de ciertos grupos de tres elementos, con una variación gradual del primero al último. Posteriormente (1827) señaló la existencia de otros grupos de tres elementos en los que se daba la misma relación (cloro, bromo y yodo; azufre, selenio y telurio; litio, sodio y potasio).
| Litio | LiCl LiOH | Calcio | CaCl2 CaSO4 | Azufre | H2S SO2 | ||||||
| Sodio | NaCl NaOH | Estroncio | SrCl2 SrSO4 | Selenio | H2Se SeO2 | ||||||
| Potasio | KCl KOH | Bario | BaCl2 BaSO4 | Telurio | H2Te TeO2 |
A estos grupos de tres elementos se les denominó tríadas y hacia 1850 ya se habían encontrado unas 20, lo que indicaba una cierta regularidad entre los elementos químicos.
Döbereiner intentó relacionar las propiedades químicas de estos elementos (y de sus compuestos) con los pesos atómicos, observando una gran analogía entre ellos, y una variación gradual del primero al último.
En su clasificación de las tríadas (agrupación de tres elementos) Döbereiner explicaba que el peso atómico promedio de los pesos de los elementos extremos, es parecido al peso atómico del elemento de en medio. Por ejemplo, para la tríada Cloro, Bromo, Yodo los pesos atómicos son respectivamente 36, 80 y 127; si sumamos 36 + 127 y dividimos entre dos, obtenemos 81, que es aproximadamente 80 y si le damos un vistazo a nuestra tabla periódica el elemento con el peso atómico aproximado a 80 es el bromo lo cual hace que concuerde un aparente ordenamiento de tríadas.
[editar]
ChancourtoisEn 1864, Chancourtois construyó una hélice de papel, en la que estaban ordenados por pesos atómicos (masa atómica) los elementos conocidos, arrollada sobre un cilindro vertical. Se encontraba que los puntos correspondientes estaban separados unas 16 unidades. Los elementos similares estaban prácticamente sobre la misma generatriz, lo que indicaba una cierta periodicidad, pero su diagrama pareció muy complicado y recibió poca atención.
[editar]
Ley de las octavas de NewlandsEn 1864, el químico inglés John Alexander Reina Newlands comunicó al Royal College of Chemistry (Real Colegio de Química) su observación de que al ordenar los elementos en orden creciente de sus pesos atómicos (prescindiendo del hidrógeno), el octavo elemento a partir de cualquier otro tenía unas propiedades muy similares al primero. En esta época, los llamados gases nobles no habían sido aún descubiertos.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Li 6,9 Na 23,0 K 39,0 | Be 9,0 Mg 24,3 Ca 40,0 | B 10,8 Al 27,0 | C 12,0 Si 28,1 | N 14,0 P 31,0 | O 16,0 S 32,1 | F 19,0 Cl 35,5 |
Esta ley mostraba una cierta ordenación de los elementos en familias (grupos), con propiedades muy parecidas entre sí y en Periodos, formados por ocho elementos cuyas propiedades iban variando progresivamente.
El nombre de octavas se basa en la intención de Newlands de relacionar estas propiedades con la que existe en la escala de las notas musicales, por lo que dio a su descubrimiento el nombre de ley de las octavas.
Como a partir del calcio dejaba de cumplirse esta regla, esta ordenación no fue apreciada por la comunidad científica que lo menospreció y ridiculizó, hasta que 23 años más tarde fue reconocido por la Royal Society, que concedió a Newlands su más alta condecoración, la medalla Davy.
[editar]
Tabla periódica de MendeléyevEn 1869, el ruso Dmitri Ivánovich Mendeléyev publicó su primera Tabla Periódica en Alemania. Un año después lo hizo Julius Lothar Meyer, que basó su clasificación periódica en la periodicidad de los volúmenes atómicos en función de la masa atómica de los elementos.
Por ésta fecha ya eran conocidos 63 elementos de los 90 que existen en la naturaleza. La clasificación la llevaron a cabo los dos químicos de acuerdo con los criterios siguientes:
- Colocaron los elementos por orden creciente de sus masas atómicas.
- Situaron en el mismo grupo elementos que tenían propiedades comunes como la valencia.
La primera clasificación periódica de Mendeléyev no tuvo buena acogida al principio. Después de varias modificaciones publicó en el año 1872 una nueva Tabla Periódica constituida por ocho columnas desdobladas en dos grupos cada una, que al cabo de los años se llamaron familia A y B.
Esta tabla fue completada a finales del siglo XIX con un grupo más, el grupo cero, constituido por los gas noble descubiertos durante esos años en el aire. El químico ruso no aceptó en principio tal descubrimiento, ya que esos elementos no tenían cabida en su tabla. Pero cuando, debido a su inactividad química (valencia cero), se les asignó el grupo cero, la Tabla Periódica quedó más completa.
El gran mérito de Mendeléyev consistió en pronosticar la existencia de elementos. Dejó casillas vacías para situar en ellas los elementos cuyo descubrimiento se realizaría años después. Incluso pronosticó las propiedades de algunos de ellos: el galio (Ga), al que llamó eka–aluminio por estar situado debajo del aluminio; el germanio (Ge), al que llamó eka–silicio; el escandio (Sc); y el tecnecio (Tc), que, aislado químicamente a partir de restos de un sincrotrón en 1937, se convirtió en el primer elemento producido de forma predominantemente artificial.
[editar]
La noción de número atómico y la mecánica cuánticaLa tabla periódica de Mendeléyev presentaba ciertas irregularidades y problemas. En las décadas posteriores tuvo que integrar los descubrimientos de los gases nobles, las "tierras raras" y los elementosradioactivos. Otro problema adicional eran las irregularidades que existían para compaginar el criterio de ordenación por peso atómico creciente y la agrupación por familias con propiedades químicas comunes. Ejemplos de esta dificultad se encuentran en las parejas telurio–yodo, argón–potasio y cobalto–níquel, en las que se hace necesario alterar el criterio de pesos atómicos crecientes en favor de la agrupación en familias con propiedades químicas semejantes.
Durante algún tiempo, esta cuestión no pudo resolverse satisfactoriamente hasta que Henry Moseley (1867–1919) realizó un estudio sobre los espectros de rayos X en 1913. Moseley comprobó que al representar la raíz cuadrada de la frecuencia de la radiación en función del número de orden en el sistema periódico se obtenía una recta, lo cual permitía pensar que este orden no era casual sino reflejo de alguna propiedad de la estructura atómica. Hoy sabemos que esa propiedad es el número atómico (Z) o número de cargas positivas del núcleo.
La explicación que aceptamos actualmente de la "ley periódica" descubierta por los químicos de mediados del siglo pasado surgió tras los desarrollos teóricos producidos en el primer tercio del siglo XX. En el primer tercio del siglo XX se construyó la mecánica cuántica. Gracias a estas investigaciones y a los desarrollos posteriores, hoy se acepta que la ordenación de los elementos en el sistema periódico está relacionada con la estructura electrónica de los átomos de los diversos elementos, a partir de la cual se pueden predecir sus diferentes propiedades químicas.
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| I A | II A | III B | IV B | V B | VI B | VII B | VIII B | VIII B | VIII B | I B | II B | III A | IV A | V A | VI A | VII A | VIII A | |
| Periodo | ||||||||||||||||||
| 1 | 1 H | 2 He | ||||||||||||||||
| 2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr |
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe |
| 6 | 55 Cs | 56 Ba | * | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn |
| 7 | 87 Fr | 88 Ra | ** | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo |
| Lantánidos | * | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu | |
| Actínidos | ** | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | 103 Lr |
| Alcalinos | Alcalinotérreos | Lantánidos | Actínidos | Metales de transición |
| Metales del bloque p | Metaloides | No metales | Halógenos | Gases nobles y Transactínidos |
EL DESARROLLO HISTÓRICO DE LA QUÍMICA
Época primitiva.
No hay duda que la Química debía nacer con la conquista del fuego por el hombre, y que sus orígenes deberán encontrarse en las artes y oficios técnicos del hombre primitivo, de los que tenemos idea por los materiales usados por él y encontrados en los restos de las civilizaciones desaparecidas. Los artículos normalmente encontrados son de metal, cerámica, vidrio, pigmentos y telas teñidas, por lo que la extracción de los metales de sus menas, la fabricación de vidrios y cerámica, las artes de la pintura y del teñido, así como la preparación de perfumes y cosméticos, práctica de la momificación y otros oficios análogos seguidos en las civilizaciones primitivas, constituyen los conocimientos sobre los que está basada la «Química» de aquellos tiempos.
El hombre primitivo se interesaría en primer lugar por los metales por ser materiales resistentes y duraderos a los que podía dárseles forma con mayor o menor facilidad. Su utilización constituye las sucesivas edades del oro y plata, del bronce y del hierro.
Los objetos más antiguos conocidos son de oro, situándose en una época anterior a los 5000 años a. J.C. Por hallarse este metal libre y por su bello color, su inalterabilidad y su rareza ha sido siempre el metal precioso por excelencia. Para los chinos tenía incluso propiedades sobrenaturales al creer que el que comía en un plato de oro llegaba a una edad avanzada, y el que absorbía oro se hacía inmortal y tenía el privilegio de desplazarse instantáneamente de un lugar a otro.
Por encontrarse a veces juntos el oro y la plata, y ser su separación difícil, se obtenía una aleación, el electrón (por su parecido al ámbar), que durante un gran tiempo se consideró un metal distinto.
En la Edad del oro y de la plata se conoció también el cobre, y no puede negarse que el primer hombre que obtuvo deliberadamente este metal a partir de alguno de sus minerales sería un verdadero genio.
Doctrinas químicas antiguas.
El hombre prehistórico, al buscar el origen y la naturaleza de todo lo que le rodeaba creó los mitos en los que cada cosa, cada fuerza natural era un dios o una figura humana; de aquí las teogonías y las cosmogonías de los pueblos primitivos, en las que los fenómenos se imaginan producidos por la acción de agentes sobrenaturales cuya intervención' explica todas las anomalías aparentes del universo. Este estado teológico de la Ciencia se mantuvo hasta el siglo VI a. J.C., en que apareció en Grecia un poderoso movimiento intelectual y sus más grandes filósofos especularon sobre el mundo y sobre la naturaleza de la materia, y plantearon claramente muchos de los problemas fundamentales de la Ciencia. La idea de la existencia de un principio permanente origen de todo fue ya un principio tangible; para TALES, de Mileto (aproximadamente 624-565 a. J.C.) fue el agua; ANAXIMENES (alrededor de 585-524 a. J.C.) sostuvo que era, el aire, y para HERACLITO, de Efeso (aproximadamente 540-475 a. J.C.) era el fuego. Más, tarde, EMPÉDOCLES, de Agrigento (alrededor de 500-430 a. J.C.) aceptó los elementos de sus antecesores, a los que agregó
 uno más, la tierra, substituyendo así el principio único de la Escuela naturalista Jónica por los cuatro elementos: tierra, agua, aire y fuego, que servían de alguna manera de soporte a las cualidades fundamentales de caliente y frío, y seco y húmedo, y dos fuerzas cósmicas, el amor y el odio, que son las raíces de todas las cosas. Esta teoría de los cuatro elementos fue aceptada por ARISTÓTELES de Estagira (384-322 antes de J.C.), el más grande pensador griego y un infatigable escritor, cuya autoridad hizo que perdurase durante unos dos mil años.
uno más, la tierra, substituyendo así el principio único de la Escuela naturalista Jónica por los cuatro elementos: tierra, agua, aire y fuego, que servían de alguna manera de soporte a las cualidades fundamentales de caliente y frío, y seco y húmedo, y dos fuerzas cósmicas, el amor y el odio, que son las raíces de todas las cosas. Esta teoría de los cuatro elementos fue aceptada por ARISTÓTELES de Estagira (384-322 antes de J.C.), el más grande pensador griego y un infatigable escritor, cuya autoridad hizo que perdurase durante unos dos mil años. En realidad, los cuatro elementos no eran más que la generalización y representación de una observación familiar, pues un cuerpo es sólido (tierra), líquido (agua) o gaseoso (aire), o bien se encuentra en estado de incandescencia (fuego). Pueden incluso imaginarse como vestigios lejanos de las teogonías prehistóricas al suponer el hombre primitivo el dios Viento, el dios Trueno, el dios Lluvia y eldios Rayo, que poco a poco irían perdiendo su carácter sobrenatural y que en la imaginación fogosa de EMPÉDOCLES pasaron a la categoría de simples elementos.
En realidad, los cuatro elementos no eran más que la generalización y representación de una observación familiar, pues un cuerpo es sólido (tierra), líquido (agua) o gaseoso (aire), o bien se encuentra en estado de incandescencia (fuego). Pueden incluso imaginarse como vestigios lejanos de las teogonías prehistóricas al suponer el hombre primitivo el dios Viento, el dios Trueno, el dios Lluvia y eldios Rayo, que poco a poco irían perdiendo su carácter sobrenatural y que en la imaginación fogosa de EMPÉDOCLES pasaron a la categoría de simples elementos. Por la misma época, LEUCIPO y su discípulo DEMÓCRITO, de Abdera (460-370 a. J.C.), en oposición a ZENÓN, de Elea, enseñaron la discontinuidad de la materia formada de átomos, el ser, y de vacío, el no ser, resultante de los intersticios entre aquellos, y permitiendo su movimiento. Los átomos son eternos, indivisibles (de donde deriva su nombre), y de la misma naturaleza, pero difieren en forma, por el orden en que están colocados en el cuerpo, por su posición relativa y por su magnitud. A pesar de la tendencia positiva de las ideas de DEMÓCRITO, Sus seguidores no desarrollaron su pensamiento que ofrece una estrecha relación con las teorías científicas modernas. EPICURO, de Samos (342-270 a. J.C.), el más ilustre de ellos, creó la palabra átomo y le asignó un peso esencial. El atomismo de DEMÓCRITO, expuesto en forma brillante en el inmortal poema De rerum Natura del romano LUCRECIO, está construido totalmente por conceptos filosóficos, y no es hasta 1677 en que BOYLE lo establece y DALTON en 1803 lo desarrolla como resultado de observaciones científicas.
Puede parecer sorprendente que los grandes pensadores griegos no buscasen una confirmación experimental de sus abstracciones, pero ellos aceptaban que todo conocimiento debía adquirirse únicamente mediante pura especulación y que el experimento no sólo era innecesario sino que incluso disminuiría su dignidad. Este error del empleo del razonamiento sin experimentación mantuvo estacionado el progreso de la Ciencia durante muchos siglos.
A partir del año 300 a. J.C. la ciencia griega se desplaza a Alejandría, en cuya Escuela florecieron grandes matemáticos, astrónomos y biólogos, si bien fue decayendo hasta apagarse hacia el año 400 de nuestra Era. En el siglo II a. J.C. las ideas científicas llegaron a Roma, pero los romanos, guerreros y constructores, pero poco abiertos a las cosas del espíritu, y estoicos frente a la Naturaleza, no prosiguieron la herencia científica de los griegos.
La Alquimia.
En la Edad Media, y especialmente en el período del 400-1000, conocido por la Edad Tenebrosa, la preocupación teológica llena los espíritus y únicamente hacia el siglo VII empieza a adquirir la Ciencia entre los árabes una cierta importancia. Los conocimientos químicos aprendidos de los egipcios y las ideas filosóficas heredadas de los antiguos a través de la Escuela alejandrina dieron a la alquimia en manos de los árabes, y después en toda Europa, una significación especial.

Esta transmutación, conocida como la «Gran Obra», debía realizarse en presencia de la «piedra filosofal» cuya preparación fue la tarea primera de los alquimistas. En el siglo XIII se extendió el objetivo de la alquimia al buscar el «elixir filosofal o de larga vida», imaginado como una infusión de la piedra filosofal, el cual debía eliminar la enfermedad, devolver la juventud, prolongar la vida e incluso asegurar la inmortalidad. Se comprende que los alquimistas viejos dedicasen sus últimas fuerzas a la consecución de este sueño.
Hoy conocemos que el problema de los alquimistas no era en esencia absurdo, aunque sí por la enorme desproporción entre los medios de que disponían y los que serían necesarios. La producción artificial del oro para la ciencia del Medioevo era un simple problema de técnica como puede serlo la del diamante para nosotros o la fabricación de albuminoides.
La Alquimia fue, en general, una práctica secreta debido a los hombres que la relacionaban con la magia y a causa de Dios, pues los alquimistas se creían los elegidos para ser depositarios de la verdad y por ello no debían divulgar sus conocimientos. Escribieron en un lenguaje hermético describiendo más bien operaciones qué hechos y haciendo uso de signos y símbolos. Un libro de alquimia, el Liber Mutus, no contiene ningún texto sino quince grabados, en su mayoría ininteligibles, para hacer conocer la preparación de la piedra filosofal.
La Iatroquímica y el renacimiento científico.
Aunque la transmutación de los metales fue creída hasta el siglo XIX, la Alquimia fue perdiendo su carácter ideal para ser, en un gran número, de sus supuestos cultivadores, charlatanería y engaño, llegándose a prohibir por Reyes y Papas. A principios del siglo XVI los esfuerzos de muchos alquimistas se dirigen a preparar drogas y remedios al señalar PARACELSO (1493-1541) que la misión de la Alquimia era la curación de la enfermedad. Aparece una transición entre la Alquimia y la verdadera Química, que se conoce como iatroquímica o química médica. PARACELSO, cuyo verdadero nombre es Felipe Aureolo Teofrasto Bombast de Hohenheim, médico suizo, alquimista y profesor, de carácter violento, jactancioso y charlatán, pues pretendió haber realizado un minúsculo ser de carne y hueso, el homúnculus, desempeñó la primera cátedra de Química creada en Basilea, en 1527, la que abandonó para viajar por toda Europa, ejerciendo una gran influencia más que por sus propios descubrimientos por el ardor con que defendía sus ideas.
Contemporáneo de PARACELSO es Georg AGRICOLA (1496-1555), de su: verdadero nombre Landmann, médico sajón, que en su obra De Re Metallica expone en forma clara, desprovista de especulaciones filosóficas, todos los conocimientos metalúrgicos de la época, y en la que se manifiestan preocupaciones de químico y de ingeniero. La Metalurgia había adquirido en esta época, en los distritos mineros de Bohemia, un gran desarrollo, lo que condujo a una fabricación industrial de ácidos y a practicar el ensayo de minerales, inicio del análisis químico.
Seguidores de PARACELSO, pero más claros y menos imbuidos de superstición, son LIBAVIUS (1540-1616), médico alemán que prepara el cloruro estánnico, estudia los fundentes en Metalurgia y obtiene muchos medicamentos; VAN HELMONT (1577-1644), médico belga, profundamente religioso y un gran investigador -es notable su investigación acerca del crecimiento de un pequeño sauce, que duró cinco años- que combate los cuatro elementos de ARISTOTELES, eliminando el fuego y la tierra, que inventa la palabra gas y al que debemos los estudios sobre el gas silvestre (gas carbónico); y LEMERY (1645-1715) que escribe su voluminoso Cours de Chymie en el que describe las distintas operaciones de la Química.
La teoría del flogisto.
Los químicos de la época de BOYLE estaban poco preparados para aceptar sus ideas, pero en cambio, atraídos por sus experimentos acerca de los gases, investigaron con estas nuevas substancias y estudiaron de una manera general el problema de la combustión.
Se debe a Georg Emst STAHL (1660-1734), químico y médico alemán, la teoría del flogisto, que aunque falsa, tiene no obstante el mérito de ser la primera teoría capaz de coordinar el conjunto de los fenómenos esenciales de la combustión y de la reducción. STAHL basa su teoría en las ideas del alquimista alemán J. J. BECHER (1635-1682), el cual, al admitir el elemento terroso, el elemento combustible y el elemento metálico no hace más que desarrollar la vieja noción de los tres elementos cuyo origen debe buscarse en las «exhalaciones» de ARISTÓTELES; un claro ejemplo de la pervivencia de las ideas.
La teoría del flogisto, conocida también como «sublime teoría», supone que toda sustancia combustible, tal como un metal, contiene un «principio inflamable», denominado posteriormente,flogisto; en la combustión se desprende el flogisto con acompañamiento de luz y calor y queda un residuo, la “ceniza” o “cal” del cuerpo combustible. Cuanto más inflamable es un cuerpo tanto más rico es en flogisto. El proceso de combustión puede expresarse en la forma simplificada siguiente:
Metal (en la combustión) à Cal + Flogisto
El principal interés de la teoría está en que explica el fenómeno inverso de la combustión, la reducción, pues si se calienta la cal (las cenizas metálicas) con una sustancia rica en flogisto, tal como el carbón, ésta cede su flogisto a la cal y el metal se revivifica. Esto es, abreviadamente,
Cal + Carbón à Metal
Así, por ejemplo, el plomo calentado en el aire se transforma en un compuesto amarillo, el litargirio; el plomo es litargirio más flogisto. El carbón, arde y casi no deja cenizas; es flogisto casi puro. Si se calienta litargirio con carbón recupera la cantidad precisada de flogisto y se convierte de nuevo en plomo metálico.
Varios metales tratados por diversos ácidos desprenden el mismo gas, el aire inflamable (nuestro hidrógeno), que era así considerado como el flogisto común a todos los metales. El negro de humo era imaginado como flogisto puro.
Lavoísíer y la revolución química.
Aunque la obra de experimentadores tan notables como SCHEELE, PRIESTLEY y CAVENDISH condujo a numerosísimos descubrimientos, su interpretación mediante la teoría del flogisto impedía todo progreso en el conocimiento de los fenómenos químicos. Es Antoine Laurent LAVOlSlER (1743-1794) el que destruye la teoría del flogisto al establecer la naturaleza verdadera de la combustión, y que en su obra Tratado elemental de Química, aparecido en 1789, crea las bases de la química moderna que, en consecuencia, ha podido ser considerada como una ciencia francesa.

LAVOISIER establece la noción precisa de cuerpo puro al demostrar que la destilación repetido del agua no cambia sus propiedades, adopta el concepto de elemento de BOYLE, pero lo basa en el resultado experimental, halla la composición del agua, no sólo por síntesis sino por análisis, y da al aire inflamable de CAVENDISH el nombre de hidrógeno (engendrador de agua) y piensa que todos los ácidos contienen oxígeno (que significa engendrador de ácidos), pues si bien se conoce el ácido muriático (el ácido clorhídrico) se le cree un ácido oxigenado.
En todas sus investigaciones utiliza sistemáticamente el principio de la conservación de la materia, «nada se pierde, nada se crea», del que en realidad no fue autor ya que era aceptado implícitamente por otros químicos y que debe atribuirse al médico y químico francés Jean REY (1583-1645), que estudió también la calcinación de los metales y, al atribuirla al aire, fue un precursor de LAVOISIER.
La revolución química producida por las ideas de LAVOISIER condujo a una nueva nomenclatura, que hoy nos parece tan natural, en la que los nombres de los cuerpos dan idea de su constitución. Esta labor fue debida, junto a LAVOISIER, a Guyton DE MORVEAU, BERTHOLLET y FOURCROY, que publicaron en 1787 su obra Método de nomenclatura química, en la que se introducen nombres que aún se utilizan.
La Química como ciencia. Desde Lavoísíer hasta nuestros días.
El progreso de la Química en los últimos 160 años constituye en realidad el contenido de un tratado moderno de Química. No obstante, mencionaremos aquí sus extremos más importantes.


El descubrimiento de la pila eléctrica por VOLTA (1800) da origen a la Electroquímica, con los descubrimientos de nuevos elementos (cloro, sodio, potasio) por DAVY, y de las leyes de la electrólisis por FARADAY (1834)
La química orgánica se desarrolla más tarde con los trabajos de LIEBIG sobre el análisis elemental orgánico iniciado por LAVOISIER, losconceptos de isomería y de radical introducidos por LIEBIG y BERZELIUS (1823), la representación de edificios moleculares por KEKULÉ (1858), y con la destrucción de la doctrina de la fuerza vital realizada por BERTHELOT (1853 al 1859) al obtener por síntesis numerosos compuestos orgánicos.
La Termoquímica, con la medida de la energía calorífica puesta en juego en las reacciones químicas, iniciada por LAVOISIER y LAPLACE, adquiere un significado especial a partir de los estudios de HESS, THOMSEN y BERTHELOT (1840) al querer medir los químicos las afinidades entre los cuerpos reaccionantes.
Para explicar el comportamiento de las substancias, gaseosas resurge a mediados del siglo pasado la teoría cinética de los gases y del calor, la cual afianza la creencia en la naturaleza atomística de la materia y extiende su utilidad al suministrar una imagen íntima del mecanismo de los procesos químicos.
LABORATORIO
El laboratorio es un lugar dotado de los medios necesarios para realizar investigaciones, experimentos, prácticas y trabajos de carácter científico, tecnológico o técnico; está equipado con instrumentos de medida o equipos con que se realizan experimentos, investigaciones o prácticas diversas, según la rama de la ciencia a la que se dedique. También puede ser un aula o dependencia de cualquier centro docente, acondicionada para el desarrollo de clases prácticas y otros trabajos relacionados con la enseñanza.
Su importancia, sea en investigaciones o a escala industrial y en cualquiera de sus especialidades (química, dimensional, electricidad, biología, etc.), radica en el hecho de que las condiciones ambientales están controladas y normalizadas, de modo que:
- Se puede asegurar que no se producen influencias extrañas (a las conocidas o previstas) que alteren el resultado del experimento o medición:control.
- Se garantiza que el experimento o medición es repetible, es decir, cualquier otro laboratorio podría repetir el proceso y obtener el mismo resultado:normalización.
La historia de los laboratorios está influida por la historia de la medicina, ya que el hombre, al profundizar acerca de cómo es su organismo, ha requerido el uso de laboratorios cada vez más especializados.

ELEMENTOS DEL LABORATORIO
Tubo de ensayo
Tubo de cristal cerrado en uno de sus extremos para realizar experiencias o pruebas con pequeñas cantidades. A través de ellos se puede observar las diferencias de color o donde hay separaciones de materiales.
Los tubos de ensayo pueden estar formados por distintas clases de vidrio. Unos son de vidrio termoresistente, diferenciado mediante marcas blancas, el cual tiene la particularidad de poder exponerse al fuego, sin romperse. Los otros no poseen esta característica.
Para calentar la sustancia que se encuentra en el tubo de ensayo se coloca en un vaso de precipitado, poniéndolo a baño de María, ya que si se calienta directamente en el mechero, el experimento será expulsado.
Al concluir el experimento, se los coloca en una gradilla para observar los tubos y realizar mejor las comparaciones.
Vaso de Precipitado
Recipiente de vidrio de forma cilíndrica y fondo plano, usado en el laboratorio para contener líquidos que interviene en procesos químicos, como la precipitación. Consiste en separar un sólido de un líquido en el que está mezclado sin disolverse. El sólido precipita (se hunde), si posee mayor peso específico que el líquido. De lo contrario, flota.
Además sirve para realizar vaporizaciones rápidas, ya que posee una boca ancha, y para mezclar allí varios elementos.
Matraz de Erlenmeyer
Vaso de vidrio, generalmente de forma cónica y con cuello recto de longitud y anchuras variables.
Nos permite conservar en su interior líquidos que se evaporan fácilmente durante una experimentación, ya que debido a su pequeña boca, se le puede colocar un tapón. Además permite la salida lenta de vapores y agregar otros elementos para experimentar.
Vidrio de Reloj y Cristalizador
Se caracterizan por poseer las mismas propiedades: poseen poca profundidad y tiene forma cóncava. Se utiliza para cubrir y sostener preparados. Además permiten realizar el proceso de Cristalización, que consiste en la separación en forma de cristales de un sólido disuelto en agua, mediante la vaporización de la misma.
Pipeta
Tubo de vidrio graduado con medidas, con un margen de error considerable, que se emplea para sacar de un recipiente pequeñas porciones de líquidos. Para esto, se coloca la pipeta dentro del recipiente hasta que se llene. Luego, se cubre con un dedo su orificio superior y se traslada hacia el otro recipiente, en el cual verteremos las pequeñas porciones de líquido. Destapando, el líquido caerá en forma de gotas (movimientos lentos y alternativos) gracias a la presión atmosférica.
Bureta
Tubo de cristal dispuesto de una manera que pueda verterse gota a gota el líquido que contenga. Está graduado para conocer el volumen del mismo. Este elemento posee la misma función que el anterior, pero con la diferencia que es más preciso ya que posee un robinete (válvula) en su parte inferior, el cual se mantiene cerrado en posición horizontal y al girarlo podemos regular la caída del líquido.
Probeta
Tubo de cristal con pie de forma cilíndrica, con un extremo cerrado destinado a la contención de líquidos, con graduaciones visibles para poder medir y trasvasarlos. Las medidas son mayores a la de la pipeta y la bureta.
Embudo
Instrumento hueco de vidrio, terminado en canuto para trasvasar líquidos. Además, interviene en el proceso de filtración (filtrar líquidos para separar los sólidos que contengan), siempre que se le agregue un papel de filtro.
Tubo de seguridad
Elemento de vidrio utilizado para traspasar líquidos. Su forma de copa y el largo del canuto impiden el desborde y ayudando a que el líquido sea vertido en el lugar que deseamos.
Ampolla de decantación
Recipiente de vidrio de cuello largo y angosto, y cuerpo ancho y redondo. Por tener boca chica, puede ser cerrado mediante un tapón. En su cuello posee un robinete para permitir el proceso de decantación: separación de un líquido con más densidad respecto de otro menos denso, los cuales se encuentran mezclados, pero sin disolverse. El que posee mayor peso específico decanta, y al abrir el robinete, se vierte en otro recipiente el líquido decantado.
Balón de destilación
Es un recipiente de vidrio de forma esférica y cuello largo, balón con un tubo lateral de desprendimiento. Dentro del mismo, se coloca el sistema que se desea fraccionar en fase líquida.
Tubo refrigerante
Tubo de vidrio donde la circulación de agua fría, a contracorriente con los vapores que se desprenden, los enfría y los condensa.
Soporte universal
Caño de metal con pie, con la función de sostén de otros elementos, utilizando distintas pinzas.
Pinzas
Cada uno de estos instrumentos de metal, es utilizado para unir los distintos elementos al soporte universal, que se encargará del sostén.
Su función específica es sostener ampollas de decantación y embudos.
Se utiliza para afirmar instrumentos de pequeño diámetro, como termómetros y tubos.
Se emplea para sujetar el balón de destilación.
Mechero, Trípode y Rejilla
El mechero es un tubo metálico que se destina para calentar distintos tipos de sustancias.
El trípode, como su nombre lo indica, es un armazón metálico de tres pies, en el que se apoya la rejilla para permitir que el fuego proveniente del mechero llegue con menos intensidad al balón de destilación.
La rejilla de amianto (material no inflamable) tejida en forma de red, está constituida por un conjunto de varillas metálicas, de poco grosor, y colocadas con escasa separación entre sí. Se apoya sobre el trípode para que la llama, llegue uniformemente a toda la superficie del vaso de precipitado.

![[quimica.jpg]](http://3.bp.blogspot.com/_zpq4XUzOMzQ/SNKM--Mf76I/AAAAAAAAACU/u0FbTSako40/s1600/quimica.jpg)
La temperatura es el nivel de calor en un gas, líquido, o sólido. Tres escalas sirven comúnmente para medir la temperatura. Las escalas de Celsius y de Fahrenheit son las más comunes. La escala de Kelvin es primordialmente usada en experimentos científicos.

Escala Celsius
La escala Celsius fue inventada en 1742 por el astrónomo sueco Andrés Celsius. Esta escala divide el rango entre las temperaturas de congelación y de ebullición del agua en 100 partes iguales. Usted encontrará a veces esta escala identificada como escala centígrada. Las temperaturas en la escala Celsius son conocidas como grados Celsius (ºC).
Escala Fahrenheit
La escala Fahrenheit fue establecida por el físico holandés-alemán Gabriel Daniel Fahrenheit, en 1724. Aun cuando muchos países están usando ya la escala Celsius, la escala Fahrenheit es ampliamente usada en los Estados Unidos. Esta escala divide la diferencia entre los puntos de fusión y de ebullición del agua en 180 intervalos iguales. Las temperaturas en la escala Fahrenheit son conocidas como grados Fahrenheit (ºF).
Escala de Kelvin
La escala de Kelvin lleva el nombre de William Thompson Kelvin, un físico británico que la diseñó en 1848. Prolonga la escala Celsius hasta el cero absoluto, una temperatura hipotética caracterizada por una ausencia completa de energía calórica. Las temperaturas en esta escala son llamadas Kelvins (K).
Cómo Convertir Temperaturas
A veces hay que convertir la temperatura de una escala a otra. A continuación encontrará cómo hacer esto.

- Para convertir de ºC a ºF use la fórmula: ºF = ºC x 1.8 + 32.
- Para convertir de ºF a ºC use la fórmula: ºC = (ºF-32) ÷ 1.8.
- Para convertir de K a ºC use la fórmula: ºC = K – 273.15
- Para convertir de ºC a K use la fórmula: K = ºC + 273.15.
- Para convertir de ºF a K use la fórmula: K = 5/9 (ºF – 32) + 273.15.
- Para convertir de K a ºF use la fórmula: ºF = 1.8(K – 273.15) + 32.
Comparación entre Temperaturas
A continuación encontrará algunas comparaciones comunes entre temperaturas de las escalas Celsius y Fahrenheit.
| TEMPERATURA | ºC | ºF |
| Punto Ebullición Agua | 100 | 212 |
| Punto Congelación Agua | 0 | 32 |
| Temperatura Corporal Promedio del Cuerpo Humano | 37 | 98.6 |
| Temperatura ambiente confortable | 20 to 25 | 68 to 77 |

